Wer fragt sich nicht manchmal: „Geht der Test noch? Kann ich den
selber nachprüfen oder gar selber kalibrieren?“ Wenn man selbst kalibrieren will,
also Messreagenzien bestimmen, Vergleichslösungen herstellen, um den Messwert
durch Farbvergleich zu ermitteln, Messreagenzien auf Genauigkeit prüfen will,
benötigt man Lösungen mit möglichst genau bekannten Inhaltsstoffen.
Diese Lösungen sind oft selbst herstellbar, es werden lediglich von
wasserlöslichen Verbindungen der Anteil am Molekulargewicht des gewünschten
Stoffes berücksichtigt. Erforderlich ist eine genaue Waage für sehr geringe
Mengen, diverse Messbecher sowie destilliertes Wasser, manchmal auch doppelt
destilliertes.
Für manche Messungen sind Vergleichslösungen schwierig herzustellen, z.B. pH, oder
ungenau bzw. leicht flüchtig (z.B.: CO2 oder O2) oder
einfach in konzentrierter Form nicht ungiftig (z.B.: Nitrit).
Für etliche Messungen sind die Lösungen aber relativ problemlos herzustellen.
Die sehr geringe Konzentration der Stoffe im Wasser oder die Kurzlebigkeit der
Stoffe führt dazu, dass solche Lösungen oft nur einige Tage oder auch nur
Stunden haltbar sind und frisch angesetzt werden müssen. Die Herstellung erfolgt
fast durchwegs durch Auflösung der entsprechenden Stoffe in destilliertem
Wasser. Es muss sehr genau gearbeitet werden.
2.) Ammonium bzw. Ammoniak in einer Testverdünnung ist relativ leicht herzustellen, deswegen
haben wir es als Beispiel für eine genaue Anleitung gewählt - bei den anderen
Substanzen ist gleicherart vorzugehen:
Wir haben Ammoniumchlorid mit der Formel NH4Cl. Mit dem
Periodensystem der Elemente (Internet) finden wir die Massezahlenen: N =
14,007, H = 1.0079, Cl = 35,451. Wir haben 4 H (H4). Also N + 4H +
Cl = 53,49g/mol. Das ist das spezifische Gewicht unserer Substanz: Eine
bestimmte, definierte Anzahl an Molekülen wiegt genau 53,49g.
Wir brauchen aber davon nur NH4+, das ist das
Ammoniumion. N + 4xH = 18,04g/mol. Dieselbe definierte Anzahl an Ammoniumionen
wiegt nur 18,04g. Wenn wir also 18,04g Ammonium möchten, müssen wir von der
Substanz Ammoniumchlorid 53,49g einwägen, da der Anteil, den Ammoniumchlorid
in der Gesamtsubstanz einnimmt, also nur etwa ein Drittel ausmacht. In diesem
Fall wollen wir sinnvollerweise vielleicht 1g, und müssen somit 53,49g/18,04g
= 2,97g einwägen. Diese Menge lösen wir nun komplett in 1 Liter destilliertem
Wasser.
Wenn wir nicht soviel destilliertes Wasser verbrauchen wollen, können wir auch
die Hälfte nehmen: Also 1.49g in 500ml, oder ein Viertel 0.74g in 250ml, aber
je kleiner die Einwaagen sind, desto ungenauer wird es natürlich, denn auch
jede Waage bringt einen internen Fehler mit. Der ist immer die letzte Stelle
auf der Digitalanzeige, manchmal auch die vorletzte, das steht dann im
Datenblatt drin.
Jetzt haben wir unsere Stammlösung und am besten beschriften wir diese auch
sofort. Die Stammlösung ist im Fall von Ammonchlorid nicht haltbar, muss also
am selben Tag verbraucht werden, sonst ist sie nicht mehr genau.
Nun kommen die Verdünnungen. Wir machen diese in einen Bereich von 0,05 bis
2mg/L. Das ist ein sinnvoller Bereich. Im Prinzip reicht auch 1mg/L als obere
Grenze, dann erhalten wir eine schöne Gerade. Um von 1g/L, also 1000mg/L auf
2mg/L zu kommen, müssen wir 1:500 verdünnen. (1000:2 = 500). Entweder mit
einer 1ml Spritze, oder gleich mit der Waage geben wir GENAU 1 Milliliter von
der Stammlösung in einen neuen Krug mit 500ml destilliertem Wasser, rühren
gut um und beschriften ihn mit "2mg/L Amm.".
In sechs weitere Glaeser geben wir nun zuerst jeweils 50 ml destilliertes
Wasser. Das können Sie mit der Waage oder mit einem kleinen Messkolben abmessen.
Mit der Waage können Sie Wasser oder stark verdünnte Lösungen bemessen, da
bei Wasser die mL (Milliliter) gleich sind wie die g (Gramm). Bei allen anderen
Flüssigkeiten geht das nicht, sie haben eine unterschiedliche Dichte.
Alle Gefässe beschriften! Entweder mit Marker oder kleine Zettelchen mit
Tixoband oder sonstwas. Am besten so: 1mg/L Amm; 0,5mg/L Amm; 0,25mg/L Amm; 0,125mg/L
Amm; 0,062mg/L Amm und 0,031 mg/L Amm.
Jetzt kommen von der 2mg/L-Lösung 50ml ins erste Glas, gut umrühren. Davon
kommen wieder 50ml ins zweite Glas, gut umrühren, davon wieder 50ml ins
dritte, usw. Dann brauchen wir noch einen Nullwert, dazu füllen wir in ein
Glas nur destilliertes Wasser und beschriften es. Es enthält 0mg/L Ammonium.
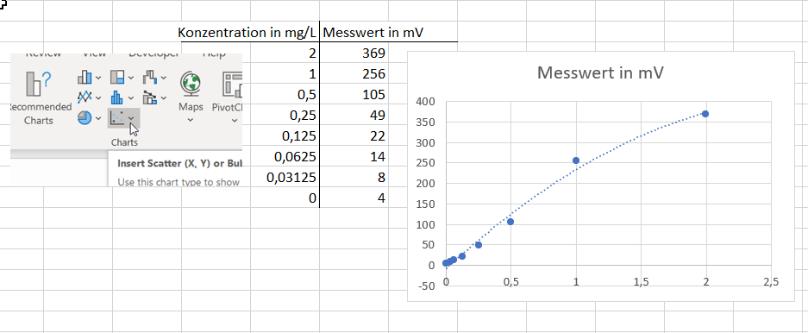
Wir haben jetzt 8 Verdünnungen: 2; 1; 0,5; 0,25; 0,125; 0,063; 0,031 und
0mg/L. Diese messen Sie im Fotometer oder fotografieren den fertigen Test für
eine Farbtafel. Also: Test durchführen entsprechend der Anleitung, mit z.B.
5ml der jeweiligen Verdünnung als Wasserprobe statt dem Aquariumwasser. Wie
wenn die Gläser jetzt alle ihre Aquarien wären, entnehmen Sie je eine
Wasserprobe und messen sie alle. Die Probe enthaelt keine weiteren
Einflussfaktoren, sondern wirklich nur die Messubstanz Ammonium, keine
Wasserfärbung, keine Huminstoffe oder irgendwelche anderen Substanzen. Am
besten messen wir jede Probe mindestens 2x, am besten 3x, je nachdem wieviel
Testsubstanz Sie dafür verwenden wollen und wie genau das Ergebnis sein soll.
Wahrscheinlich reicht 2x pro Probe, ausser die Werte liegen weit auseinander,
dann braucht es eine dritte oder vielleicht sogar 4. Messung und nimmt den
Mittelwert.
Die Messpunkte werden dann z.B. auf Millimeterpapier eingetragen
oder in ein Programm wie MS Excel eingegeben und als XY-Kurve dargestellt.